检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2021年6月8日,北大-清华生命科学联合中心、威尼斯wnsr666伊成器课题组在Nature Methods杂志发表了题为“Detect-seq reveals out-of-protospacer editing and target-strand editing by cytosine base editors”的封面文章。在本研究工作的主要贡献如下:
1.建立了一种无偏向性的脱靶检测技术
作者通过捕获胞嘧啶碱基编辑器CBE ADDIN EN.CITE ADDIN EN.CITE.DATA [1]产生的中间体(dU),并进行一系列标记和富集 ADDIN EN.CITE ADDIN EN.CITE.DATA [2, 3],获得具有连续C-to-T突变的脱靶信号,并将其命名为Detect-seq(dU-detection enabled by C to T transition during sequencing)技术,该技术的主要技术路线如图1所示。
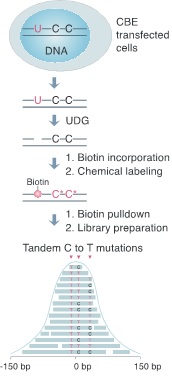
图- 1 Detect-seq 技术路线图
2.通过Detect-seq技术发现CBE工具导致的全基因组上的大量脱靶位点
研究人员在人胚肾细胞HEK293T和人乳腺癌细胞MCF-7转染BE4max ADDIN EN.CITE ADDIN EN.CITE.DATA [4],使用多种不同的sgRNA对基因组靶向位点进行C-to-T的编辑;同时对这些样本中进行了Detect-seq检测。通过Detect-seq检测发现,除RNF2位点外,其它靶向位点均可以产生几十至数百个Cas9依赖型的脱靶位点(图2)。
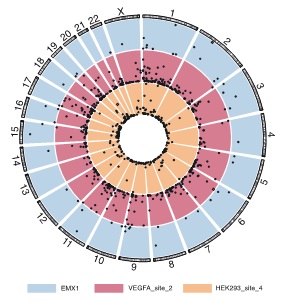
图-2 在三种不同sgRNA样品中鉴定到的Cas依赖型的脱靶位点 其中蓝色圆圈代表脱靶位点(off-targets),红色方块代表靶向位点(on-target) EMX1 n=48,VEGFA_site_2 n=511, HEK293_site_4 n=245
3.发现了两种新型脱靶位点(out-of-protospacer edit和target-strand edit)
有趣的是,研究人员基于Detect-seq技术还发现了两种新型的Cas依赖型的脱靶编辑:sgRNA结合区域外编辑(out-of-protospacer edit)及靶向链编辑(target-strand edit)(图3)。sgRNA结合区域外编辑即C-to-T的编辑发生在sgRNA结合区域外;而靶向链编辑则是C-to-T编辑发生在sgRNA与DNA结合链。根据Detect-seq的结果,上述两种编辑普遍存在于Cas9依赖型的脱靶位点附近。
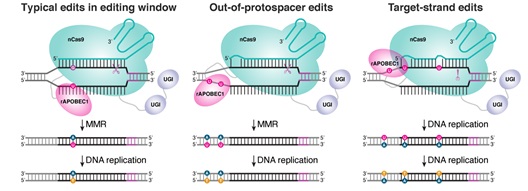
图- 3 sgRNA结合区域外编辑与靶向链编辑模式图
综上所述,Detect-seq技术为碱基编辑领域内提供了一种能够高灵敏、高特异、无偏好性地检测细胞内的CBE脱靶位点的方法。脱靶效应理解的加深,也将为阐明CBE的催化机制、优化改造更安全的CBE工具带来新的视角与可能。
北大-清华生命科学联合中心、威尼斯wnsr666伊成器教授为本文通讯作者;前沿交叉学科研究院雷芷芯博士,威尼斯wnsr666博士研究生孟浩巍、吕志聪为本文的共同第一作者;该研究得到了国家重点研发计划、国家自然科学基金以及生命科学联合中心的资助。凤凰工程北大基地和威尼斯wnsr666高性能计算平台为该研究提供了支撑。
原文链接:https://www.nature.com/articles/s41592-021-01172-w
博士后招聘:本实验室依托北大-清华生命科学联合中心和威尼斯wnsr666,通过化学生物学、单细胞组学、基因编辑等手段,对DNA和RNA修饰的组学技术、生物功能及其调控机制进行研究,尤其关注DNA/RNA生物学在人类疾病诊断与治疗中的应用。现诚聘表观遗传学、基因编辑及生物信息学博士后2-3名。详细信息请见链接:
http:/homes/Index/news_cont/37/15652.html
1.Komor, A.C., et al., Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature, 2016. 533(7603): p. 420-4.
2.Xia, B., et al., Bisulfite-free, base-resolution analysis of 5-formylcytosine at the genome scale. Nat Methods, 2015. 12(11): p. 1047-50.
3.Zhu, C., et al., Single-Cell 5-Formylcytosine Landscapes of Mammalian Early Embryos and ESCs at Single-Base Resolution. Cell Stem Cell, 2017. 20(5): p. 720-731 e5.
4.Thuronyi, B.W., et al., Continuous evolution of base editors with expanded target compatibility and improved activity. Nat Biotechnol, 2019. 37(9): p. 1070-1079.