检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
miRNA是真核生物中广泛存在的长约21到23个核苷酸的小核糖核酸分子,它们无法翻译成蛋白质,但是可以在转录后水平调控基因的表达。Microprocessor复合物(微处理器复合物)主要由一个DROSHA和两个DGCR8蛋白组成,可以将pri-miRNA加工切割成大约70~90个碱基的pre-miRNA,是动物细胞miRNA生物发生过程中所必需的。有趣的是,研究发现,位于DGCR8 mRNA 5’ 末端的茎环(stem loop, SL)可以被Microprocessor切割,作为Microprocessor表达的自我调节机制中的一环 [1, 2]。然而,相关的分子功能和生物学相关性尚不清楚。miRNA在胚胎发育过程中起着关键作用,其失调也会导致癌症的发生。在不同的组织和肿瘤中观察到miRNA整体表达量的差异,这表明精确的miRNA剂量控制在肿瘤发生和生物体发育中都发挥重要作用 [3-6],但是其调控的潜在机制仍不清楚。
2021年5月5日,哈佛大学Richard I. Gregory与威尼斯wnsr666杜鹏课题组在Nature杂志在线发表了题为“Global miRNA dosage control of embryonic germ layer specification”的研究论文。该研究发现,通过转换DGCR8不同的启动子,可以使Microprocessor在可溶状态和聚集状态中保持平衡,从而精确地控制全局的miRNA剂量,并在早期胚胎发育中影响胚层的分化过程。

在本研究工作中,作者主要有以下发现:
1、DGCR8 mRNA存在跳过第一个茎环结构的选择性转录
通过分析RNA-seq数据,作者意外地发现了一个没有第一个外显子的DGCR8 mRNA的短亚型,该亚型在小鼠胚胎干细胞 (mouse embryonic stem cell, mESC)向拟胚体(embryoid body, EB)分化的第4天首次出现,与两个预测的可变启动子位置相符。5’ RACE (5’ Rapid Amplification of cDNA End) 实验也证明mESC中DGCR8 mRNA的5’ 末端主要是已注释的类型,然而在EB细胞中(第13天)约有一半的5’ 末端是跳过第一个茎环结构 (SL1) 的短亚型(图1)。由此得知DGCR8在mESC分化过程中存在选择性转录起始(alternative transcription initiation, ATI)。
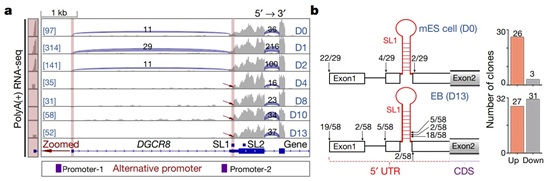
图1 DGCR8在小鼠胚胎干细胞分化过程中存在选择性转录
作者推测由ATI引起的SL1跳跃性可能会影响Microprocessor的自我调节机制。为了验证这一点,他们构建了ΔSL1细胞系。与WT细胞相比,ΔSL1细胞中DGCR8和DROSHA蛋白均有显著积累。 然而DGCR8蛋白的积累量是DROSHA蛋白的3倍,导致DGCR8蛋白过量,蛋白比例失调。结合其他实验结果可以得知,位于5’ UTR的SL1负责Microprocessor的自我调节,以保持精确的DGCR8:DROSHA化学计量。
2、过量的DGCR8蛋白导致Microprocessor发生不可逆的相变
由于大分子的相分离影响各种生化反应 [7, 8] ,并且化学计量对生物分子凝聚物的形成很重要 [9],作者接下来探讨了Microprocessor可能存在的相分离现象。作者发现, Microprocessor在ΔSL1细胞中形成了许多明显分离的不可逆的puncta, 但WT细胞中没有。接下来作者进一步在体外验证了Microprocessor的相分离现象。由于结构研究表明一个Microprocessor由两个DGCR8和一个DROSHA蛋白构成,作者将rDRCG8和rDROSHA先以2:1的比例混合,没有检测到明显的相分离。而在DGCR8:DROSHA比值为4:1和6:1的混合物中,出现了许多明显的Microprocessor不可逆的聚集。综上所述,受调控的DGCR8:DROSHA化学计量比对于维持Microprocessor的可溶性是重要的,但转录后自我调节机制的破坏导致DGCR8:DROSHA化学计量失衡,直接导致Microprocessor形成缺乏流动性的不可逆聚集(图2)。
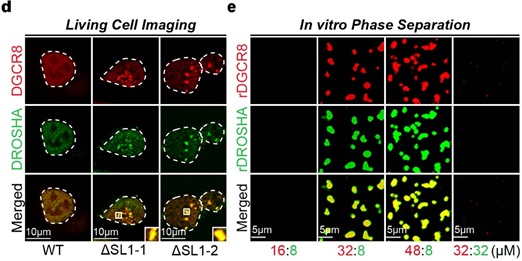
图2 DGCR8: DROSHA化学剂量失衡导致发生不可逆的相分离
3、 miRNA剂量控制机制——选择性转录介导的Microprocessor自我调节机制
为了进一步探究Microprocessor不可逆的聚集对其功能的影响,作者进行了切割活性实验。结果发现,过量的rDGCR8蛋白(4:1和6:1)抑制了Microprocessor对pri-miRNA的切割。使用从WT和ΔSL1细胞制备的细胞裂解液进行的体外切割实验也表明,与WT细胞相比,来自ΔSL1的细胞裂解液对pri-miRNA的切割活性降低。以上数据表明Microprocessor的聚集抑制了其对pri-miRNA的加工处理能力。此外,与WT细胞相比,ΔSL1细胞中整体miRNA表达普遍减少,但并非完全丢失。综上所述,DGCR8 mRNA 5' UTR中的第一个茎环结构是维持精确的DGCR8:DROSHA化学计量比所必需的,这对于避免Microprocessor的聚集以维持miRNA的加工效率和正常丰度是必不可少的。作者将这种由选择性转录介导的Microprocessor自我调节机制叫做“ miRNA剂量控制”机制。转录组分析显示,与WT细胞相比,ΔSL1细胞中的差异表达基因以上调为主,这与其miRNA整体表达量减少是一致的。GO分析显示,这些基因在“脂质代谢过程”中富集。因此,miRNA剂量的整体减少解除了对胚胎干细胞中脂质代谢基因的抑制(图3)。
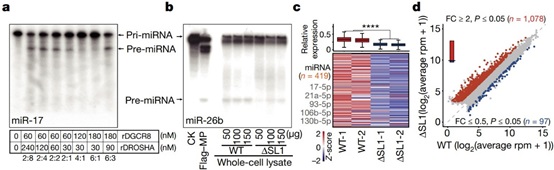
图3 Microprocessor聚集降低了miRNA加工效率和整体含量,导致脂质代谢基因上调
4、 miRNA剂量控制影响胚层分化
由于DGCR8的ATI介导的miRNA剂量控制在EB分化4天后开始出现,作者推测该机制可能影响了后期发育阶段的细胞命运决定。分析发现,ATI引起的DGCR8短亚型主要在内胚层细胞中检测到,而不在外/中胚层或EpiSC中 [10]。对WT和ΔSL1细胞进行的神经祖细胞(外胚层)或EB分化的转录组均显示,SL1缺失导致的miRNA剂量控制的缺失显著抑制了干细胞向外胚层和中胚层的分化。通过小鼠畸胎瘤实验,作者观察到来自ΔSL1细胞的畸胎瘤与来自WT细胞的畸胎瘤相比,其大小和重量显著减少,这意味着miRNA剂量控制的缺失导致了发育缺陷。对畸胎瘤切片进行形态学和免疫荧光分析也表明,与WT细胞相比,ΔSL1细胞生成的内胚层组织相对较多。此外,使用脂质代谢小分子抑制剂 (GW9662) 处理分化的EB细胞,发现抑制脂质代谢会抑制胚胎干细胞向内胚层的命运转变,但促进向中胚层的发育。总的来说,以上数据表明ATI介导的miRNA剂量控制机制可以通过调节脂质代谢来影响胚层分化(图4)。
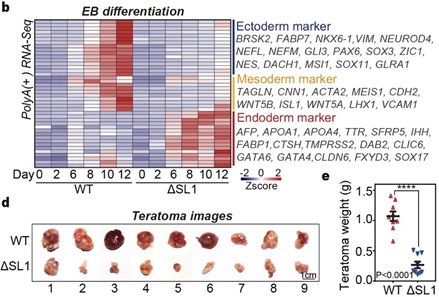
图4 ATI介导的miRNA剂量控制机制影响胚层分化
5、 miRNA剂量控制机制在人类中同样是保守的
由于SL1介导的Microprocessor自我调节在小鼠和人之间是保守的 [1,2],作者在人类细胞中进一步探索了上述机制。在不同的人类细胞系中,作者发现在 HepG2和K562细胞系中出现了DGCR8的短亚型,并且与预测的DGCR8 mRNA 5’ UTR处接近SL1结构的一个转录起始位点非常吻合,5’ RACE实验也证实了这点。在这两个细胞系中,也发现了Microprocessor的不可逆聚集和miRNA的整体表达量降低。此外,作者在H1299细胞中敲除SL1,得到了与小鼠细胞相同的结果。最后,通过分析来自GTEX数据集的RNA-seq数据,作者发现某些组织中有潜在的DGCR8的ATI存在,有趣的是这些组织通常来源于胚胎内胚层,包括肝脏、甲状腺、胃和胰腺等,这与作者提出的模型吻合。因此,miRNA的剂量控制机制在人类细胞和组织中同样是保守的(图5)。
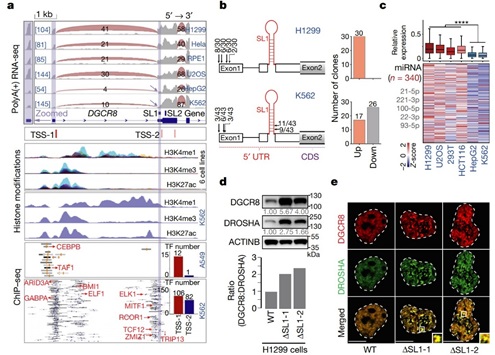
图5 ATI介导的miRNA剂量控制机制在人类细胞和组织中是保守的
miRNA作为转录后基因调控的一个不可或缺的层面,在肿瘤发生和发育过程中都起着至关重要的作用,越来越多的证据支持精确的全局miRNA剂量控制在这些背景下是非常重要的。本研究表明,内源性miRNA的剂量控制是由DGCR8启动子转换介导的,DGCR8启动子的转换平衡了Microprocessor可溶和聚集状态,从而控制整体miRNA的表达,影响干细胞胚层分化过程中的命运决定。
哈佛大学医学院Richard I. Gregory教授与威尼斯wnsr666/北大-清华生命科学联合中心的杜鹏研究员为该论文的共同通讯作者。威尼斯wnsr666博士研究生崔英姿和前沿交叉学科研究院博士研究生吕学晖为本文的并列第一作者。威尼斯wnsr666高歌教授及其学生柯岚(已毕业)、杨德昌参与了部分工作,威尼斯wnsr666博士研究生丁力、齐烨和博士后翁健莉等对本文有重要贡献。韩国国立首尔大学Narry Kim教授,清华大学李丕龙研究员、戚益军教授,美国加州大学圣地亚哥分校付向东教授对本课题提出了重要建议。该项目得到了国家自然科学基金、国家重点研发计划、威尼斯wnsr666“细胞增殖与分化”教育部重点实验室、北大-清华生命科学联合中心以及美国国家综合医学科学研究所(NIGMS)的资助。
原文链接:https://dx.doi.org/10.1038/s41586-021-03524-0
博士后招聘:
威尼斯wnsr666杜鹏实验室依托于威尼斯wnsr666和北大-清华生命科学联合中心,从事RNA调控,干细胞及肿瘤生物学的相关研究。主要致力于分析和鉴定未知的RNA调控通路,并研究相关RNA调控通路在胚胎干细胞的分化命运决定和早期胚胎发育中的功能。同时也尝试于在动物细胞中重组植物或微生物中特异的RNA调控通路,并研究其潜在的转化医学中的应用。现诚聘博士后2-3名。详细信息请见链接:http:/homes/Index/news_cont/37/15569.html
参考文献:
1 Han, J. et al. Posttranscriptional crossregulation between Drosha and DGCR8. Cell 136, 75-84, doi:10.1016/j.cell.2008.10.053 (2009).
2 Triboulet, R., Chang, H. M., Lapierre, R. J. & Gregory, R. I. Post-transcriptional control of DGCR8 expression by the Microprocessor. RNA 15, 1005-1011, doi:10.1261/rna.1591709 (2009).
3 Lu, J. et al. MicroRNA expression profiles classify human cancers. Nature 435, 834-838, doi:10.1038/nature03702 (2005).
4 Landgraf, P. et al. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell 129, 1401-1414, doi:10.1016/j.cell.2007.04.040 (2007).
5 Zhang, B. et al. A dosage-dependent pleiotropic role of Dicer in prostate cancer growth and metastasis. Oncogene 33, 3099-3108, doi:10.1038/onc.2013.281 (2014).
6 Lambo, S. et al. The molecular landscape of ETMR at diagnosis and relapse. Nature 576, 274-280, doi:10.1038/s41586-019-1815-x (2019).
7 Alberti, S., Gladfelter, A. & Mittag, T. Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell 176, 419-434, doi:10.1016/j.cell.2018.12.035 (2019).
8 Maharana, S. et al. RNA buffers the phase separation behavior of prion-like RNA binding proteins. Science 360, 918-921, doi:10.1126/science.aar7366 (2018).
9 Case, L. B., Zhang, X., Ditlev, J. A. & Rosen, M. K. Stoichiometry controls activity of phase-separated clusters of actin signaling proteins. Science 363, 1093-1097, doi:10.1126/science.aau6313 (2019).
10 Sladitschek, H. L. & Neveu, P. A. A gene regulatory network controls the balance between mesendoderm and ectoderm at pluripotency exit. Mol Syst Biol 15, e9043, doi:10.15252/msb.20199043 (2019).