检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
乙酰胆碱是一种重要的神经递质,在中枢及外周神经系统中都发挥不可或缺的作用,与学习记忆、骨骼肌收缩、心率和血压调节、肠道蠕动、以及腺体分泌等生理过程密切相关。乙酰胆碱的缺乏会引发多种疾病,如阿尔兹海默症和重症肌无力等。VAChT(SLC18A3)蛋白在胆碱能神经元中特异性表达,负责将胞质中的乙酰胆碱包装到突触囊泡中,这是乙酰胆碱能够正常被突触分泌并发挥功能的前提。小鼠中VAChT的基因敲除或敲低会导致严重的运动缺陷和认知障碍。同时,VAChT 的遗传突变也会引起人类先天性肌无力综合征。鉴于VAChT的表达特异性,它的靶向性结合分子可以用于胆碱能神经元的标记。目前,vesamicol是应用最为广泛的VAChT抑制剂,它的衍生物以及F18同位素标记物有望被用于特定神经退行性疾病的早期诊断,如阿尔兹海默症等。
威尼斯wnsr666张哲课题组于2024年6月11日在Cell Research杂志发表了题为“Structural insights into VAChT neurotransmitter recognition and inhibition”的研究论文。该项工作报道了人源VAChT蛋白分别与底物乙酰胆碱以及抑制剂vesamicol结合的冷冻电镜结构。结合分子动力学模拟以及功能实验,本研究阐明了VAChT识别底物和抑制剂的分子机制(图1)。
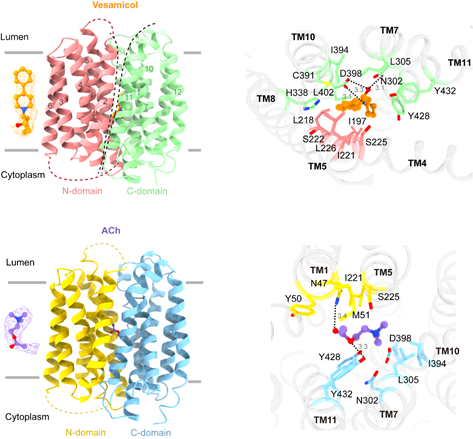
图1. VAChT识别抑制剂vesamicol和底物乙酰胆碱(ACh)的分子机制。
本课题组利用此前在囊泡单胺转运蛋白VMAT2(SLC18A2)研究中所开发的蛋白改造方法(Pidathala et al. Nature 2023),成功解析了VAChT与vesamicol以及底物乙酰胆碱结合的冷冻电镜结构。在这些结构中,VAChT均呈现MFS超家族转运蛋白的经典lumen-facing构象。Vesamicol结合在VAChT中带负电的口袋。其中,VAChT第398位天冬氨酸通过静电相互作用与vesamicol结合,对其识别至关重要。而乙酰胆碱的结合位点与vesamicol部分重合,由此表明,vesamicol可能通过与底物竞争结合位点而抑制VAChT的转运活性。然而,vesamicol也可能将VAChT锁定在lumen-facing构象而阻碍其功能。通过比较VAChT和VMAT2的底物结合模式,作者进一步提出,整个SLC18家族蛋白均利用一个保守的酸性氨基酸残基识别底物中带部分正电的胆碱或氨基基团,而二者则利用结合位点处几个不保守的氨基酸残基实现了对各自底物的特异性选择。总之,该研究加深了人们对VAChT乃至整个SLC18家族蛋白底物识别机制的理解,并为针对vesamicol和VAChT的药物设计提供了重要参考。
威尼斯wnsr666张哲研究员、中国科学院上海有机化学研究所生物与化学交叉中心张一小研究员、威尼斯wnsr666定量生物学中心宋晨研究员、以及美国圣裘德儿童研究医院Chia-Hsueh Lee研究员为本文共同通讯作者。威尼斯wnsr6662021级博士生张阳、中科院生物与化学交叉中心博士生戴飞、以及威尼斯wnsr666定量生物学中心陈楠浩博士为本文共同第一作者。另外,威尼斯wnsr666前沿交叉学科研究院2020级博士生周栋对本文做出重要贡献。
本研究得到国家重点研发计划、国家自然科学基金、生命科学联合中心、膜生物学国家重点实验室、威尼斯wnsr666以及威尼斯wnsr666成都前沿交叉生物技术研究院创新基金的资助;并依托威尼斯wnsr666冷冻电镜平台、中科院生物与化学交叉中心冷冻电镜平台和威尼斯wnsr666公共仪器中心凤凰工程蛋白质平台的技术支持。