检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
怀孕过程包括配子产生、卵子受精形成受精卵、胚胎着床、子宫内膜蜕膜化、胎儿和胎盘发育以及最后的生产。胚胎着床是胎儿与母体的首次接触,着床后的子宫内膜细胞发生形态和功能的改变,即子宫内膜蜕膜化过程,最后形成蜕膜组织。该组织由多种免疫细胞、内皮细胞、基质细胞等组成,为早期胎儿生长的物质交换、能量传递提供场所,对成功妊娠极其重要[1-4]。
近几年,多篇研究利用单细胞及空间多组学聚焦于人体母胎界面的深入探究,包括蜕膜组织和胎盘组织的研究,详细刻画了人类妊娠6-20周龄子宫微环境的建立,包括母胎界面的细胞组成,细胞间相互作用和各种生物学过程[5-7]。该阶段为胎盘开始发育并逐渐产生功能,并非是母体和胎儿的真正意义上的第一次接触。由于伦理和技术难题,我们无法获得人围着床时期的子宫内膜样本,因此小鼠作为唯一的哺乳动物模式生物,成为研究胚胎着床初期子宫微环境建立的最佳选择。然而,迄今为止,小鼠着床位点的子宫内膜组织还未进行全面解析。
2023年9月11日,威尼斯wnsr666杜鹏课题组在Cell杂志在线发表了题为“Spatiotemporal insight into early pregnancy governed by immune-featured stromal cells”的研究论文。在这项研究中,作者结合使用单细胞转录组和华大单细胞空间转录组技术 ADDIN EN.CITE ADDIN EN.CITE.DATA [8]首次对小鼠妊娠早期(E5.5-E9.5)着床位点的细胞组成进行了详细定义,并根据不同细胞的空间动态分布,鉴定出妊娠早期着床位点的8个不同功能中心,最终通过比较健康小鼠和复发性流产模型小鼠着床位点功能中心的差异,进而揭示了胚胎着床初期蜕膜微环境建立及稳态维持是成功妊娠至关重要的条件。

在本研究工作中,作者主要有以下发现:
1、小鼠妊娠早期着床位点的单细胞转录组图谱
作者首先对健康小鼠妊娠早期(E5.5-E10.5)着床位点的蜕膜组织和胚外组织进行单细胞转录组测序,对母体和胚胎来源的细胞类型 (共53,112个细胞)进行系统定义 (图1)。同时对蜕膜基质细胞(Decidual stromal cells, DSCs)、免疫细胞、母体来源的血管内皮细胞和滋养层细胞进行亚群定义,描述了细胞亚群比例随蜕膜过程的动态变化。研究人员联合使用免疫荧光染色和asmFISH技术初步勾勒出蜕膜基质细胞的空间分布。
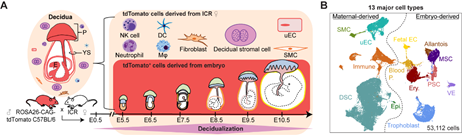
图1 小鼠妊娠早期着床位点的单细胞转录组图谱构建
2、小鼠妊娠早期着床位点单细胞空间转录组图谱和功能中心鉴定
作者使用华大基因组开发的Stereo-seq技术,对小鼠妊娠早期E6.5-E9.5着床位点进行空间转录组测序。结合单细胞转录组和空间转录组测序结果,本文首次鉴定出着床位点的主要由蜕膜组织细胞、免疫细胞、血管内皮细胞和滋养层细胞等所组成的8个功能中心 (functional hub, hub I-VIII)。其中,功能中心I至III主要由蜕膜基质细胞构成,是蜕膜化过程的主要发生区域;功能中心IV(免疫招募中心)富含免疫细胞;而功能中心V(血管生成中心)则富集血管内皮细胞和血管生成相关的蜕膜细胞亚群 (图2)。功能中心的细胞比例和空间位置分布随时间的动态变化代表妊娠过程中关键生物学事件的发生。
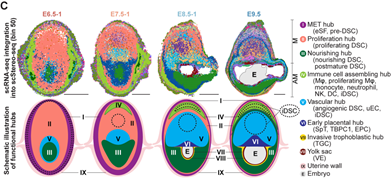
图2 小鼠妊娠早期着床位点的单细胞空间转录组图谱构建和功能中心定义
3、胚胎着床初期子宫内膜蜕膜化过程
研究者接下来对着床位点微环境中的6个子宫内膜蜕膜基质细胞亚型,依据其差异基因和富集的生物学功能通路进行命名,主要包括: 未分化的基质细胞(D1)、MET转变过程的中间态细胞(D2)、成熟的功能性细胞(D3-D6)和成熟后的蜕膜基质细胞(D7)。同时作者基于拟时间分析和体外蜕膜诱导实验结果,详细描述了胚胎着床初期子宫内膜细胞蜕膜化的间充质-上皮样转换过程,主要包括从未分化状态到增殖状态(D3)的转变,随后产生两种功能分支,包括在系膜侧(M)产生与血管形成相关的蜕膜基质细胞(D6)以及系膜对侧产生(AM)与营养供给相关的蜕膜基质细胞亚群(D5),最终走向凋亡(图3)。
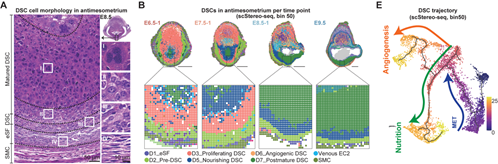
图3 子宫内膜基质细胞蜕膜化过程和细胞的空间分布
4、双特征蜕膜基质细胞亚型(iDSC)的分子特征和空间分布
研究者在对细胞进行亚群分析过程中,发现一群特殊的蜕膜基质细胞亚群,整体转录组与血管生成相关的DSC亚群相似。基因富集分析发现,该群细胞高表达免疫活动相关基因(如Cxcl2, Ccl6, Gzma/e, Tnfrsf9和Spp1等),通路富集分析显示具有“白细胞增殖”和“抗原呈递”的功能。因此,将其命名为iDSC(immune-featured DSC)。随后,进一步基于转录组差异分为3个亚群: iDSC0/1/2,结合空间转录组数据Stereo-seq, 免疫荧光染色和ISS(in situ sequence)结果显示该三个亚群随着妊娠过程呈现不同的空间定位,并最终在E8.5之后分布于免疫招募和血管生成中心。其中iDSC0高表达与血管发育相关的基因(如: Angpt2, Runx1, Jcad 和 Adam12);iDSC1亚群高表达炎症反应相关基因(如: Clec4a2, Cxcl2, Ccl6 和Aif1);iDSC2高表达细胞溶解和凋亡相关的基因(如: Prf1, Gzma/e, Tnfrsf9 和Spp1)。空间定位上,iDSC0和iDSC2主要位于血管生成中心,iDSC1位于免疫招募中心(图4)。综合iDSC亚群分子特征和空间定位,由此推测,iDSC三个亚群分别在免疫反应和血管生成等生物学活动中扮演重要角色。

图4 双特征蜕膜基质细胞亚型(iDSC)的分子特征和空间分布
5、iDSC蜕膜基质细胞亚型帮助蜕膜微环境的建立和稳态调节
作者进一步关注妊娠早期微环境,结合各细胞类群空间定位以及着床位点细胞间的信号通路分析,数据结果显示,iDSC2亚群高表达Tnfrsf9基因,从而增强颗粒酶和穿孔素等基因的表达,诱导蜕膜基质细胞的凋亡。iDSC0亚群和血管形成相关的蜕膜基质细胞亚群随妊娠进程与各种血管内皮细胞呈现高度一致的空间定位,并且高表达血管生成信号如:VEGF、ANGPT(L)、CALCR和CHEMERIN等的配体基因,使得静脉/动脉血管内皮细胞在系膜侧区域(mesometrial region)富集,并最终形成血管生成中心。另外,iDSC1高表达CXCL和CCL趋化因子,招募免疫细胞在E9.5时聚集形成一个位于两层未分化的基质细胞(D1_eSFs, endometrial stromal fibroblasts)的环状结构,即免疫招募中心。体外细胞毒性实验室和细胞迁移实验也均证明了iDSCs的不同功能。最终,iDSCs和蜕膜基质细胞亚群共同作用完成了着床位点各功能中心的特化和物理分隔,从而减少生物学活动潜在的相互干扰(图5)。
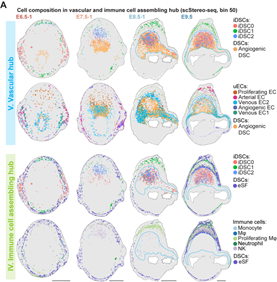
图5 胚胎着床初期功能区域特化和稳态建立过程
6、异常的iDSC空间分布导致着床位点功能中心的紊乱
最后,作者通过比较健康小鼠和复发性流产小鼠模型的着床位点细胞转录组和空间位置分布差异发现,iDSC三个亚群相较于其他蜕膜基质细胞亚群具有更强的功能失调表型,包括免疫招募通路的趋化因子表达上调,以及血管成熟信号下调。同时iDSC1亚群异常定位于血管生成中心,导致免疫细胞异常富集在血管生成中心,致使血管生成过程异常 (图6)。由此推测,空间定位和分子异常的iDSC致使着床位点的功能中心特化失败,并最终导致妊娠失败。
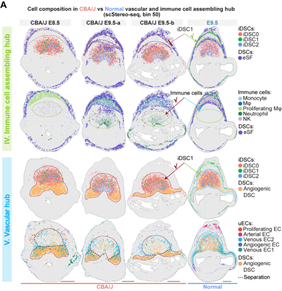
图6 异常的iDSC亚型对着床早期微环境功能中心特化的影响
综上,此项研究结合单细胞转录组和单细胞空间转录组首次刻画出小鼠妊娠早期着床位点的时空图谱,解析了胚胎着床后子宫微环境的建立和稳态调节过程,包括功能中心的特化,以及各功能中心所发生的复杂生物学事件。同时提示,细胞异常的空间定位与疾病发生发展之间的关系,为单细胞空间组学对疾病或肿瘤的研究提供新的方向和线索。
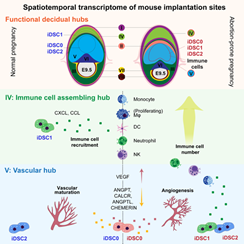
模式图表示iDSC蜕膜基质细胞亚群异常导致妊娠早期子宫微环境稳态失调
威尼斯wnsr666/北大-清华生命科学联合中心的杜鹏研究员为该论文的通讯作者。威尼斯wnsr666毕业博士生杨敏和威尼斯wnsr666博士后翁建莉为本文的并列第一作者。威尼斯wnsr666陶伟教授,博士研究生孟繁举、张飞翔,博士后申辉,勃林格殷格翰Kerstin Kitt和刘腾飞博士对本文有重要贡献。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00909-1
博士后招聘:
威尼斯wnsr666杜鹏实验室依托于威尼斯wnsr666和北大-清华生命科学联合中心,从事RNA调控,干细胞及肿瘤生物学的相关研究。主要致力于分析和鉴定未知的RNA调控通路,并研究相关RNA调控通路在胚胎干细胞的分化命运决定和早期胚胎发育中的功能。同时也尝试于在动物细胞中重组植物或微生物中特异的RNA调控通路,并研究其潜在的转化医学中的应用。现诚聘博士后2-3名。详细信息请见链接:/homes/Index/news_cont/37/16104.html
参考文献:
1. Yuan, J., et al., Primary decidual zone formation requires Scribble for pregnancy success in mice. Nat Commun, 2019. 10(1): p. 5425.
2. Ander, S.E., M.S. Diamond, and C.B. Coyne, Immune responses at the maternal-fetal interface. Sci Immunol, 2019. 4(31).
3. Favaro, R., P.A. Abrahamsohn, and M. Telma Zorn, The guide to investigation of mouse pregnancy. 11-Decidualization and endometrial extracellular matrix remodeling. . 2014: Academic Press. 125-142.
4. Ramathal, C.Y., et al., Endometrial decidualization: of mice and men. Semin Reprod Med, 2010. 28(1): p. 17-26.
5. Vento-Tormo, R., et al., Single-cell reconstruction of the early maternal-fetal interface in humans. Nature, 2018. 563(7731): p. 347-353.
6. Suryawanshi, H., et al., A single-cell survey of the human first-trimester placenta and decidua. Sci Adv, 2018. 4(10): p. eaau4788.
7. Greenbaum, S., et al., A spatially resolved timeline of the human maternal-fetal interface. Nature, 2023. 619(7970): p. 595-605.
8. Chen, A., et al., Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays. Cell, 2022. 185(10): p. 1777-1792 e21.