检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2023年8月13日,威尼斯wnsr666吴虹课题组与李程课题组合作在《Cell Reports》杂志发表了题为“PTEN Regulates Hematopoietic Lineage Plasticity via PU.1-Dependent Chromatin Accessibility”的研究论文,揭示了PTEN通过PU.1调控染色质开放性从而改变造血祖细胞谱系可塑性的机理。
造血过程是一个从可自我更新的造血干细胞(Hematopoietic stem cell,HSC)分化为功能性血细胞的过程。最近的研究表明造血干祖细胞是一群受表观遗传机制调控的、具有可塑性和异质性的细胞1,2。因此研究造血分化过程中相关的转录因子如何调节前体细胞的表观遗传状态,并启动特定谱系的分化十分重要。
PTEN作为一个重要的抑癌蛋白,在HSC自我更新、细胞命运决定、谱系定向、及抑制血液系统肿瘤的发生发展等多个环节都发挥了重要作用3。 造血干细胞中Pten缺失会导致髓系,T系和B系发育异常以及急性T淋巴细胞白血病,表明PTEN在控制造血系统多谱系分化中发挥了重要作用4,5,6。但是PTEN调控上述功能的细胞和分子机制尚不清楚。
为了探究PTEN调控造血谱系选择的机制,研究人员通过流式细胞术对野生型和Pten缺失小鼠体内的多种造血祖细胞及前体细胞做了定量分析,发现Pten缺失引起B系祖细胞prepro-B的增多。sc-RNA-seq及ATAC-seq分析以及体外培养实验表明Pten缺失会显著改变prepro-B细胞中关键谱系转录因子结合位点的染色质开放性,影响其下游靶基因的表达,最终导致B系分化潜能降低,而髓系和T系潜能增强。进一步,他们发现PU.1作为PTEN的下游关键转录因子调节谱系转录因子结合位点的开放性,而改变PU.1的水平可以重编程Pten缺失的prepro-B细胞的分化潜能。
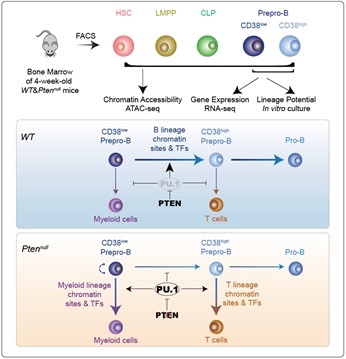
模式图:PTEN通过PU.1调控染色质开放性从而改变造血祖细胞谱系可塑性
综上所述,这项研究揭示了PTEN调控造血谱系命运决定的细胞及分子机制,提出了PTEN通过PU.1调节染色质开放性从而改变造血祖细胞谱系可塑性的模型。 Prepro-B分化潜能的可塑性及其调控机制可助力T/M和B/M混合型急性白血病(MPAL)及白血病谱系转换的研究,为临床治疗开启全新的视角。
威尼斯wnsr666吴虹教授和李程研究员为本文共同通讯作者。威尼斯wnsr666徐子晗博士、威尼斯wnsr666PTN联合项目博士生贺礼兵、威尼斯wnsr666前沿交叉学科研究院吴祎琳博士为并列第一作者。威尼斯wnsr666助理研究员杨璐参与了部分研究工作。威尼斯wnsr666胡家志研究员、清华大学医学院吴励教授和吴虹实验室已毕业的祝海川博士提供了宝贵建议。该研究得到了北大-清华生命科学联合中心(CLS)、北京未来基因诊断高精尖创新中心(ICG)、国家自然科学基金和科技部重点研发计划的资助,并得到了威尼斯wnsr666“北极星”高性能计算平台以及威尼斯wnsr666和清华大学威尼斯wnsr666仪器中心的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2211124723009786
Reference:
1. Haas, S., Trumpp, A., and Milsom, M.D. (2018). Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell 22, 627-638. 10.1016/j.stem.2018.04.003.
2. Yu, V.W.C., Yusuf, R.Z., Oki, T., Wu, J., Saez, B., Wang, X., Cook, C., Baryawno, N., Ziller, M.J., Lee, E., et al. (2016). Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell 167, 1310-1322 e1317. 10.1016/j.cell.2016.10.045.
3. Wu, Y., Zhu, H., and Wu, H. (2019). PTEN in regulating hematopoiesis and leukemogenesis. Cold Spring Harb Perspect Med. 10.1101/cshperspect.a036244.
4. Guo, W., Lasky, J.L., Chang, C.J., Mosessian, S., Lewis, X., Xiao, Y., Yeh, J.E., Chen, J.Y., Iruela-Arispe, M.L., Varella-Garcia, M., and Wu, H. (2008). Multi-genetic events collaboratively contribute to Pten-null leukaemia stem-cell formation. Nature 453, 529-533. 10.1038/nature06933.
5. Guo, W., Schubbert, S., Chen, J.Y., Valamehr, B., Mosessian, S., Shi, H., Dang, N.H., Garcia, C., Theodoro, M.F., Varella-Garcia, M., and Wu, H. (2011). Suppression of leukemia development caused by PTEN loss. Proc Natl Acad Sci U S A 108, 1409-1414. 10.1073/pnas.1006937108.
6. Zhu, H., Zhang, L., Wu, Y., Dong, B., Guo, W., Wang, M., Yang, L., Fan, X., Tang, Y., Liu, N., et al. (2018). T-ALL leukemia stem cell 'stemness' is epigenetically controlled by the master regulator SPI1. Elife 7. 10.7554/eLife.38314.